Phần cứng và Phần mềm của GMP – Thay đổi để hệ thống tốt hơn
1. Phần cứng và phần mềm của GMP.
Có hai yếu tố chính yếu nhất để đảm bảo chất lượng sản phẩm, một là thiết bị có thể hoạt động ổn định trong môi trường sạch, hai là hệ thống quản lý mà nhờ đó các hoạt động đã được lên kế hoạch được bảo đảm sẽ được thực thi. Tóm lại, cả phần cứng và phần mềm cần phải được trang bị để tuân thủ GMP.
Chúng ta hãy xem xét GMP với khía cạnh Luật dược phẩm của Nhật Bản, từ quan điểm này. “Các Quy tắc cần tuân thủ liên quan đến Nhà xưởng và các công trình dược, v.v.”, trong đó quy định các tiêu chuẩn về Nhà xưởng và thiết bị sản xuất dùng để sản xuất dược phẩm, được gọi là “Phần cứng của GMP”. Ngoài ra, “Sắc lệnh cấp Bộ về GMP” quy định hệ thống quản lý để đạt được sự đảm bảo chất lượng cao, được gọi là “Phần mềm của GMP”.
2. Thay đổi để hệ thống tốt hơn.
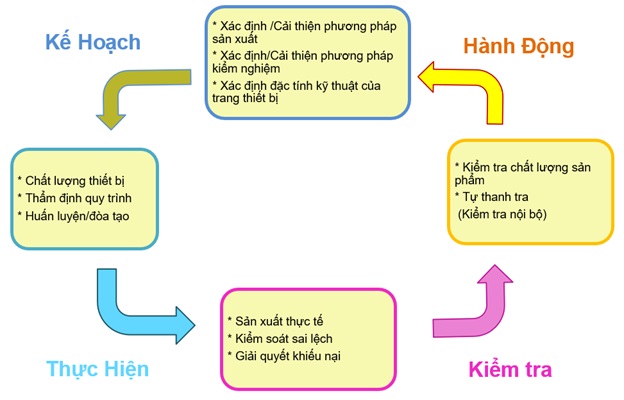
Một loạt các quy trình cấu thành các nguyên tắc cơ bản của sản xuất dược phẩm. Đó là; thứ nhất, lập thành văn bản các kế hoạch đã được xác định trước (kế hoạch); thứ hai, thực hiện nó và ghi lại nó cho phù hợp (thực hiện): thứ ba, xem xét nó (kiểm tra); thứ tư, cải thiện nó nếu nó có vấn đề (hành động). (Xem Hình.1).
“Các sự cố” có thể xảy ra, ngoài những vấn đề gây ra ‘sai lệch’ trong quy trình sản xuất như sản phẩm không phù hợp hoặc lỗi do con người, còn có các vấn đề khác sau khi sản phẩm đã được bán ra thị trường bị thu hồi hoặc khiếu nại. Khi những vấn đề này xảy ra, nguyên nhân gốc rễ cần phải được điều tra và tiến hành thực hiện các hành động ngăn chặn sự tái phát. Trong trường hợp này, không chỉ cần ngăn chặn sự tái phát bằng cách khắc phục (hành động khắc phục), mà quan trọng hơn là phải dự đoán xác suất các sự cố có thể xảy ra và ngăn chặn sự cố xảy ra (hành động phòng ngừa). Đây được gọi là CAPA (Hành động Khắc phục và Hành động Phòng ngừa). Thêm nữa, việc tự giám sát, yêu cầu các nhà sản xuất phải kiểm tra tình trạng hiện tại theo các quy trình đã được thiết lập và ghi nhận lại nó, điều này đã được quy định trong Sắc lệnh về GMP. Theo cách này, các hoạt động kiểm tra hệ thống thường xuyên phải được kết hợp với quy trình đã thiết lập để có được một hệ thống đảm bảo chất lượng tốt hơn.
Hình 1, thể hiện một chu trình được gọi là chu trình PDCA và khái niệm này cũng đã được đưa vào hệ thống quản lý được thiết lập bởi ISO (Tổ chức Tiêu chuẩn hóa Quốc tế). ISO9001, trong đó các điểm cần thiết về hệ thống quản lý (tổ chức) để đạt được sự hài lòng của khách hàng đối với sản phẩm được tổng kết trên quan điểm quản lý kinh doanh, thúc đẩy thực hiện chu trình PDCA để đạt được sự cải tiến liên tục. Đây chính là một trong những chức năng của phạm vi thuộc “trách nhiệm quản lý”.
Việc GMP hướng đến mục tiêu sản xuất ra sản phẩm đạt chất lượng cao là một yêu cầu mang tính pháp lý. Mặc dù nó khác với ISO, nhưng có nhiều quan điểm chung giữa GMP và các phương pháp quản lý chất lượng được tiêu chuẩn hóa trong ISO9000. Từ nền tảng này, ICH Q10, một hướng dẫn cho hệ thống chất lượng dược phẩm tích hợp các khái niệm của ISO9000 đã được ICH (Hội nghị quốc tế về hài hòa các yêu cầu kỹ thuật để đăng ký dược phẩm dùng cho người) thông qua và được thông báo tại Nhật Bản vào năm 2010. ICH Q10 đã trở thành một cầu nối giữa GMP và ICH.