医薬品ライフサイクルと各ステップの業務
医薬品のライフサイクルにおける各ステップでは次のような業務が行われます。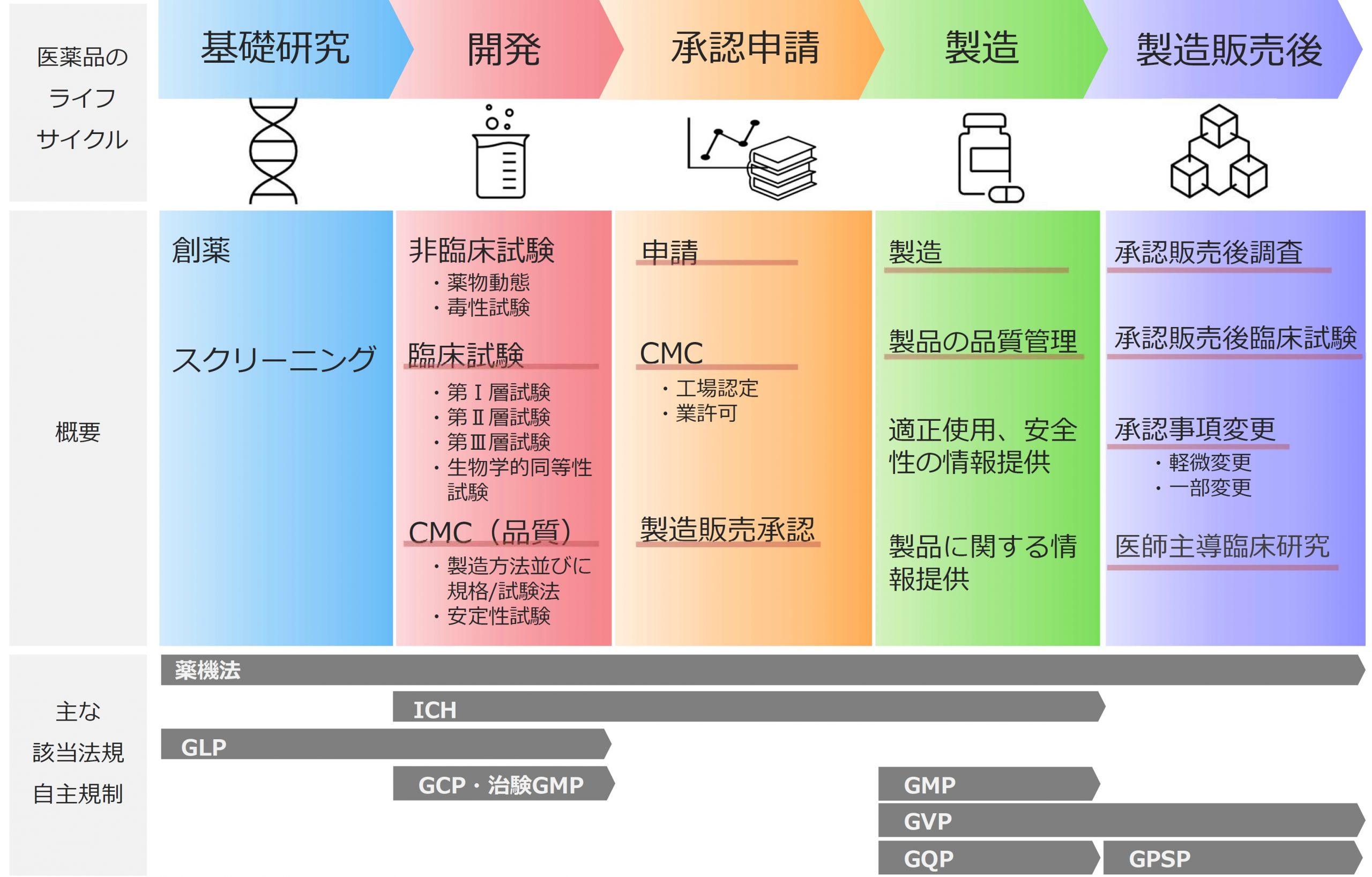
※赤下線はシーエムプラスの薬事コンサルティングサービスの範囲を示します。
シーエムプラスの薬事コンサルティング
シーエムプラスの薬事コンサルティングは、製薬業界での実務経験の豊富な薬事コンサルタントがお客様のご要望に併せたコンサルティングサービスを提供します。
- 薬事申請戦略に関するコンサルティング
- GQP / GVP 等の社内体制構築コンサルティング
- 医薬品医療機器総合機構(PMDA)への各種相談に関する支援
- 医薬品等の製造販売業 / 製造業 / 外国製造業者認定等の申請 支援(照会対応支援含む)
- 承認申請書および申請資料の作成支援
- 一部変更、軽微変更業務支援(照会対応支援含む)
シーエムプラスの薬事コンサルティングのつよみ
①開発段階から製造販売後までの全てのステージでの薬事コンサルティングサービスを提供します。
シーエムプラスでは、開発・承認申請・製造・製造販売後まで全てのステージにおいて、製薬業界での実務経験豊富な薬事コンサルタントにより、開発薬事、CMC薬事、薬制薬事の観点からコンサルティングサービスを提供します。新医薬品、後発医薬品、再審査期間終了後の医薬品と医薬品種別を問わず、対応可能です。
②GMPコンサルティングと連携した薬事コンサルティングサービスを提供します。
シーエムプラスでは、「GMPの製造部門、QAの品質保証部門の観点からのGMPコンサルティング」(現場対応)と「薬事面での解釈や書類等の手続きの観点からの薬事コンサルティング」(申請から照会対応までの規制当局との薬事対応)が可能で、両サービスを組み合わせることでより現場に即したGMP、QA、薬事面の連携コンサルティングサービスの提供が可能です。
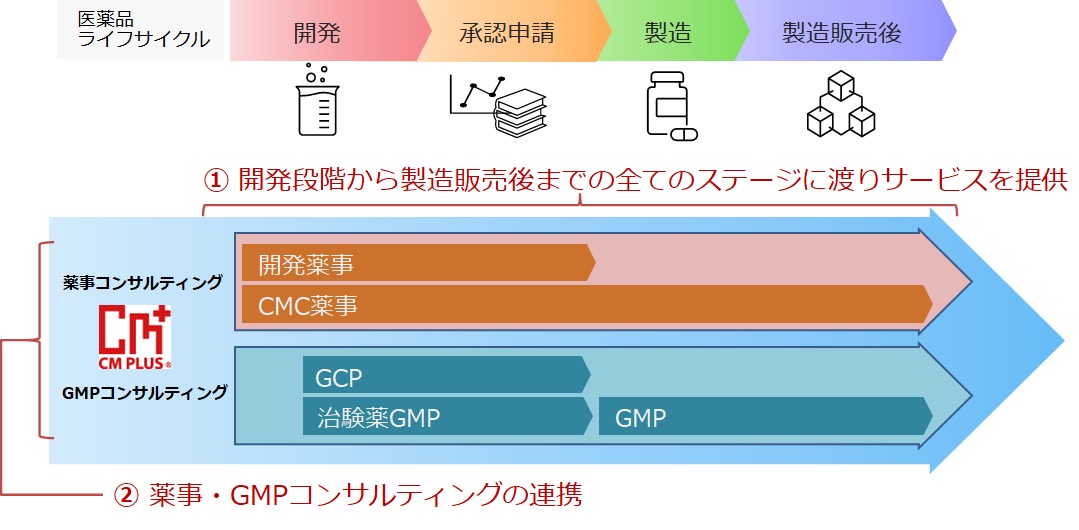 選任製造販売業者と治験国内管理人
選任製造販売業者と治験国内管理人
シーエムプラスは、第一種医薬品製造販売業並びに第二種医薬品製造販売業の業許可を取得しており、「日本の拠点」を持たない(日本国内に法人を設立していない)外国の製造業者に対し選任製造販売業者(DMAH)としてのサービスとともに治験国内管理人(ICCC:GCP省令第15条)として日本のGCP省令に適合した日本での臨床試験の運営サポート(日本国内で治験依頼者の役割)のみのサービスの提供も致します。
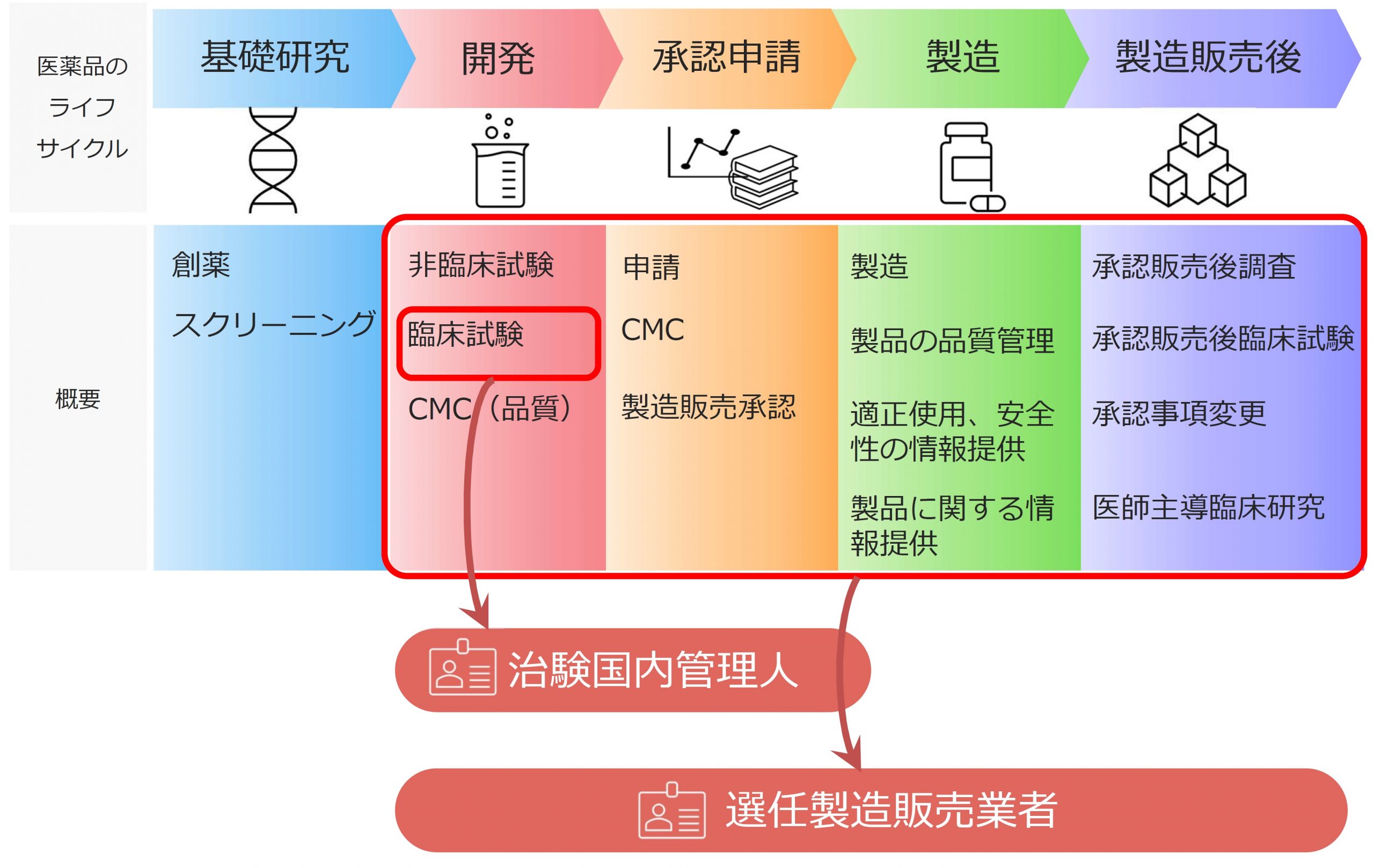 選任製造販売業者(D-MAH)サービス
選任製造販売業者(D-MAH)サービス
外国製造業者による医薬品の日本市場へ主体的な参入を可能にするサービスです。
※選任製造販売業者(D-MAH:Designated Marketing Approval Holder)
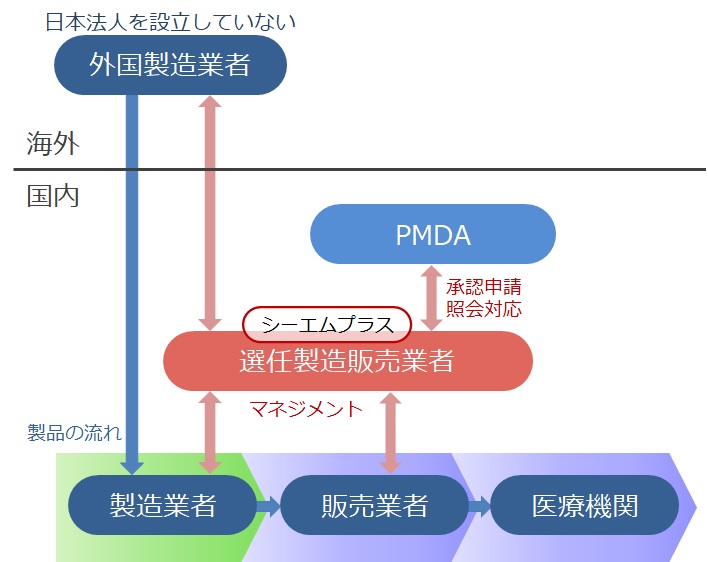 日本法人を設立していない外国製造業者等が国内で医薬品及び医療機器等を販売する際には、製造販売業者1社を選任する必要があります。
日本法人を設立していない外国製造業者等が国内で医薬品及び医療機器等を販売する際には、製造販売業者1社を選任する必要があります。
シーエムプラスは、第1種医薬品製造販売業ならびに第2種医薬品製造販売業の業許可を取得しています。
日本市場へ参入、既参入外国製造業者及び輸入販売をお考えの国内製造業者向けに選任製造販売業としてサービスをご提供致します。
治験国内管理人(ICCC)サービス
日本法人を設立していない海外の医薬品企業(製薬会社や創薬ベンチャー等)に代わり日本国内での治験実施を可能とするサービスです。
※治験国内管理人(ICCC:In-Country Clinical Caretaker)
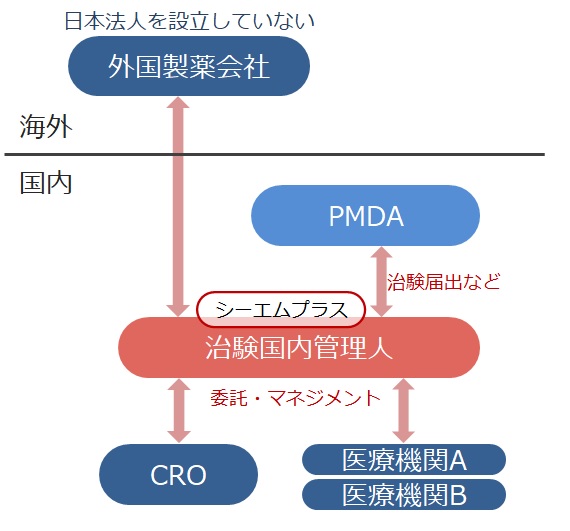 日本国内に法人を設立していない企業が国内で治験を実施する場合には、治験薬による保健衛生上の危害の発生又は拡大の防止に必要な処理を採らせるため、治験を依頼しようとする者に代わって治験の依頼を出来る者として国内に住所を有する者を選任する必要があります。
日本国内に法人を設立していない企業が国内で治験を実施する場合には、治験薬による保健衛生上の危害の発生又は拡大の防止に必要な処理を採らせるため、治験を依頼しようとする者に代わって治験の依頼を出来る者として国内に住所を有する者を選任する必要があります。
シーエムプラスは、臨床開発のパートナーとして、日本国内に法人を設立していない医薬品企業に代わり日本国内で治験依頼者の役割(治験国内管理人:GCP省令第15条)を果たします。
